自20世纪70年代染色质表观遗传学研究开始以来,组蛋白和DNA标记,特别是 DNA 甲基化已成为迄今为止研究最多和表征最多的表观遗传修饰[Razin]。DNA 甲基化作为基因表达的关键调节物在本领域内获得了显著的关注。其 对生物过程的广泛影响,从发育到疾病,重新定义了我们的 理解 基因控制和促进创新的医疗干预方法。
在发育过程中,DNA甲基化模式塑造了细胞的分化,确保了细胞的出现。 不同 具有特殊功能的细胞类型。这些模式的异常与癌症和其他疾病有关。 疾病例如,肿瘤抑制基因启动子的高甲基化和癌基因的低甲基化, 启动子有助于不受控制的细胞生长,加速癌症进展。随着调查人员深入调查 的 DNA甲基化的复杂性,理解和潜在调节这种表观遗传标记的新途径 是 正在开放,为生物医学研究和医疗保健提供变革性的进步。
编辑表观基因组
在这些革命性的创新中,表观基因组编辑产生了相当大的影响。该方法涉及 的 表观遗传标记的靶向修饰,如DNA甲基化、RNA甲基化和组蛋白修饰, 到 调节基因表达而不改变潜在的一级DNA序列。关于DNA甲基化, 表观基因组编辑的重点是改变DNA中连接到胞嘧啶碱基的甲基的模式。一个共同 方式 实现这一点的方法是通过基因工程分子或蛋白质,如DNA甲基转移酶(DNMT), 或 CRISPR-Cas系统通常是针对这一目的而定制的。
设计原则和策略
自从它在原核生物中作为一种适应性免疫系统对抗入侵的DNA噬菌体的作用被阐明以来, 然而,CRISPR-Cas很快就进入了基因工程领域,被塑造成一个 可编程 一种能够通过精确切割dsDNA序列来人工修改生物体基因组的基因编辑工具 在 所期望的位点[Jinek]。在这种情况下,该系统由两个主要组成部分组成: 络合 与Cas9内切核酸酶分别用于宿主DNA靶的位点特异性识别和切割。
自定义这些组件的能力为CRISPR-Cas提供了无限的可能性, 研究, 生物技术和医学。最近,它在基于表观遗传学的应用中发现了实用性。2016年, 几 研究小组独立开发了靶向表观基因组的CRISPR-Cas系统[Choudhury,Liu,McDonald, Vojta]。通过融合RNA引导的死亡Cas9(dCas 9;催化失活的Cas9,其可以用作递送载体), 为 其他感兴趣的酶)与5 mC甲基转移酶(dCas 9-Dnmt 3a)或脱甲基酶(dCas 9-Tet 1), 系列 5 mC编辑器具有操纵特定基因组DNA甲基化的能力, 的位点
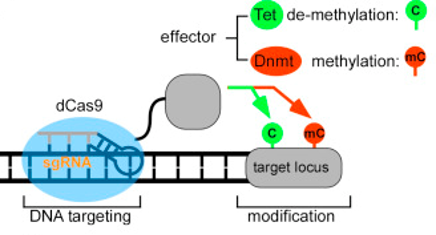
基于CRISPR-Cas的DNA甲基化编辑器的示意图(来自图1A,[Liu])。
正如杜克大学神经生物学教授兼病毒载体核心主任鲍里斯·坎特博士所说, 详细信息, “用于感兴趣基因座内表观基因组编辑的CRISPR-Cas由几个组件组成。DCAS9 作为 上述的DNA甲基化酶抑制子通常在C-末端连接。来运输复合体 成 在细胞核中,两个或甚至四个核定位信号(NLS)被用在核的N-和C-末端。 复杂. dCas 9和DNA甲基化酶通常经由支持DNA甲基化酶的正确折叠的短多肽接头分离。 的 多肽。”
“靶特异性DNA甲基化修饰依赖于Cas9融合到泰特(去甲基化)或DNMT 3A(去甲基化)。 甲基化) AlbaRodriguez-Meira博士,亨利惠康爵士博士后研究员, Dana-Farber癌症 研究所和麻省理工学院和哈佛的布罗德研究所。丹尼尔萨波日尼科夫博士,AvenCell的科学家I 治疗学, 他说:“如果细胞不分裂,某种形式的泰特酶, 事我们 目前必须是“脱甲基酶”-需要用作dCas 9融合的一部分。对于甲基化, 现在 通过dCas 9融合或募集甲基转移酶的许多变化和迭代。
应用
表观基因组编辑具有各种应用,包括基础科学研究和前瞻性治疗 对癌症和遗传病等疾病的干预。
“我想说,进入临床领域的机会最大的两个主要类别是罕见的。 疾病 和癌症,”坎特博士提出。“例如,印记疾病,如普拉德-威利和 安格尔曼综合征, 是罕见的先天性疾病,由异常剂量的印记基因引起, 甲基化编辑。
“遗传或表观遗传机制的破坏,特别是DNA甲基化,可能导致 调节 印记基因的表达,从而导致疾病。催化死亡的Cas9与DNA脱和 甲基转移酶已被证明在纠正这些疾病中具有高的表观基因组编辑效率 (主要在体外)。
“另一种可能成为CRISPRi编辑的良好靶点的疾病是Rett综合征。最后但并非 起码 通过DNA甲基化可以有效地靶向CNS疾病。事实上,我们证明了这一点。”博士 坎特群岛 他提到了他与神经病学教授兼神经病学系主任Ornit Chiba-Falek博士沿着进行的工作, 杜克大学的转化脑科学教授及其同事发表了一篇文章,讨论了SNCA升高的作用。 帕金森病(PD)的水平,并提出了涉及靶向DNA甲基化的治疗策略 内 使用CRISPR失活的Cas9系统的SNCA内含子1 [Kantor]。开发的系统,一个慢病毒载体, 账面 dCas 9和DNMT 3A显示成功下调人诱导的多能干细胞中SNCA的表达。 细胞衍生的多巴胺能神经元,为PD提供了一种潜在的新的基于表观遗传学的治疗方法。
然而,基于CRISPR-Cas的DNA甲基化编辑器的实际临床应用仍在进行中。“为了 最好的 Rodriguez-Meira博士说:”据我所知,所有试图调节DNA甲基化的临床试验 在癌症中, 广泛的DNA甲基转移酶抑制剂(氮杂胞苷和衍生物)和一种新的小分子DNMT 1 抑制剂 急性髓细胞白血病[Pappalardi]。然而,表观基因组编辑工具仍然很遥远 被 部署到诊所,据我所知,没有一个在临床试验中。
“There are not yet any clinical trials using DNA methylation editing technology,” 证实, 尽管生物技术部门在改善这一结果方面取得了进展。“初创企业报告说, 成功 在动物模型中使用表观遗传编辑技术(调谐治疗,但也色度医学是 最 在DNA甲基化编辑空间中开发了一个). Tune Therapeutics正在使用表观遗传编辑 技术(不 DNA甲基化编辑,但原理相似)来打开或关闭基因, 功能 T细胞被设计用于对抗癌症(CAR-T细胞),而不是改变癌细胞 自己在 通过这种方式,表观遗传编辑可以用于增强这种基于细胞的抗癌疗法。
主要挑战和限制
与任何早期技术一样,DNA甲基化编辑也有相当大的缺点, 微调根据Kantor博士的说法,“基于甲基化的编辑器有两个主要的限制:大小 和 效率基于DNA甲基化效应子的工具的尺寸很大,并且对于DNA甲基化效应子的使用是禁止的。 用腺相关载体[AAV]进行有效包装和递送。
“第二个限制是这些工具的效率相对较低。这源于两个原因。 第一、 DNA甲基化在有限的遗传位点控制基因表达,即使在这些区域也不是唯一的基因表达调控机制。 调解镇压过程的机制。第二,从头甲基转移酶A和B多次需要一个 额外 酶DNMT3L,其充当增强其活性的伴侣。因此,多部序列是 需要得到 可靠和可持续的影响”。
Rodriguez-Meira博士表示赞同,“关键的挑战是基于Cas9的表观基因组编辑器的规模很大,这使得它 很难在原代细胞中使用这些工具。使用这些工具实现CpG分辨率是非常重要的。 挑战性的(即,仅靶向一个特定的CpG而不靶向其周围的其它CpG),因为Cas9-泰特和 Cas9-DNMT3A 是大蛋白质。
“因此,在实践层面上,这些工具使泰特和DNMT 3A非常接近一个大的目标区域 (300-500 bp),其大量甲基化或去甲基化。除了这一挑战, 的DNA 甲基化编辑仍然非常低,需要使用几种指导RNA“平铺”靶点。 地区 获得足够的信号。因此,高效编辑通常仅限于具有以下功能的网站: 高 引导RNA设计的密度和高CpG含量。
脱靶效应是另一个仍然需要注意的缺点。“这些酶也可以很好地发挥作用, 以及 Sapozhnikov博士指出:”即使它们被庞大的dCas9束缚并靶向, 出去 “这造成了在整个基因组中广泛存在的非预期脱靶变化, 同时影响 通过混淆实验问题或引起有害变化来进行研究和治疗, 分别”。
Sapozhnikov博士继续说道:“此外,这些技术引入的变化是否稳定?效果会不会 的 DNA甲基化改变足以显著改变基因表达,那么,这是否足以 改变 疾病的过程?有许多问题必须回答,也有许多挑战有待解决。 解决”。
解决这些问题
研究人员不断开发新的工具和技术,以提高测量的精度和效率。 外基因 编辑.
“首先,DNA甲基转移酶可以包装到其他载体系统中,例如,慢病毒载体,”博士。 坎特说。 虽然AAV是常用的递送平台,由于其在转导分裂和分泌细胞中的多功能性, 非分裂细胞,以及它们的低免疫原性,它们有限的货物容量可以限制细胞的大小。 的 它们可以携带的有效载荷。作为回应,Kantor博士及其同事开发了一种整合酶缺陷型慢病毒载体 为 具有低宿主染色体整合能力的CRISPR/Cas9递送,类似于AAV [Ortinski]。“那 包装 该系统的容量是AAV的两倍。
“其次,对甲基化”敏感“位点进行更复杂的gRNA设计可以帮助改善其生物学特性。 效率 正如我们所证明的,甲基化可以被带到远离感兴趣位点的区域, 和 仍然可以非常有效地沉默所需的位点。因此,我们和其他人建议, 蔓延 DNA甲基化可以到达距离所需DNA位点数百万个碱基对的区域。
另一方面,Sapozhnikov博士开发了一种独特的表观遗传工程技术, 使用 一种酶的融合。相反,它依赖于结合的dCas9的空间位阻来物理地阻碍蛋白质的结合。 内源 靶位点的DNA甲基化机制,从而减弱不期望的酶相关副作用.
正如Sapozhnikov博士解释的那样,“这些技术通常依赖于编辑DNA的酶之间的融合 甲基化 和无核酸酶的Cas9这些酶并不是只修饰DNA甲基化的“干净”酶。它们已经进化 超过 参与一个协调的表观遗传网络-它们与其他蛋白质相互作用, 原因 除了甲基化之外,还有很多变化……在我看来,我们开发的工具是DNA的最佳工具, 脱甲基 在分裂的细胞中进行编辑,因为它做得非常干净和高效。”
关于该领域目前的其他突破,“在我看来,DNA中一些最令人兴奋的发现, 甲基化编辑涉及描述这些编辑如何随时间稳定传播新工具 和 传递’表观遗传记忆’,包括跨代遗传,”Rodriguez-Meira博士说。 “例如, 文章,如[最近的文件]从胡安卡洛斯伊兹皮苏亚贝尔蒙特,”其中提出的证据, 支持 哺乳动物(特别是小鼠)的跨代表观遗传, DNA 启动子相关CpG岛(CGI)从父母到后代的甲基化[Takahashi]。本研究利用 DNA 甲基化编辑的小鼠胚胎干细胞,显示靶向CGI甲基化和相关异常 代谢表型得以维持并在多代中传递。
Sapozhnikov博士也有类似的观点。“也许最近最有趣的发现 与 该技术的发展(我觉得,由于酶的数量有限, 组合 其可用于该技术),但与该技术的应用有关。Gabriella Ficz的 组 最近发表的一篇论文[Saunderson]表明,DNA甲基化的变化,是由 编辑可以 维持血细胞分裂和分化(即,由新细胞继承),这意味着 DNA中 用于治疗疾病的甲基化可能是持久的。
“这表明,尽管DNA甲基化变化相对容易逆转(不像DNA甲基化), 变化 DNA序列),它们仍然可以是永久性的(或至少是稳定的),允许一次完成或 低频 治疗。当然,从机械学的角度来看,我们必须再次问, 非DNA甲基化相关 由该技术引起的表观遗传效应(DNMT 3A募集其他因子)对此有贡献 这是一个很好的消息,但治疗!
DNA甲基化编辑对于推进我们对基因调控的认识和开发新的 解决遗传和表观遗传疾病的战略。该领域的研究人员继续 显著 这项技术可能会对生物学和医学产生越来越大的影响。
